El ácido sulfúrico es una sustancia con un papel fundamental en la industria y la química. Su fórmula, propiedades y aplicaciones lo convierten en un componente esencial en diversos campos (1).
Estructura y fórmula química del ácido sulfúrico
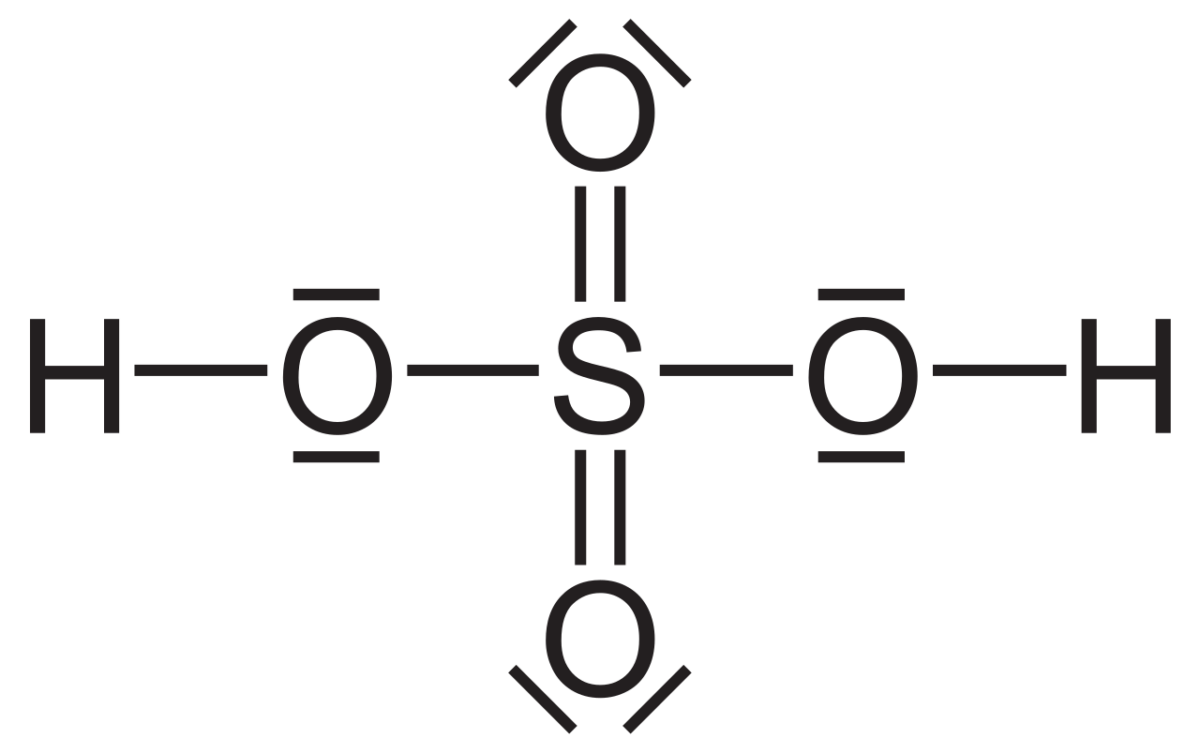
El ácido sulfúrico tiene la fórmula química H₂SO₄. Su estructura molecular revela dos grupos oxo y dos hidroxi, todos covalentemente unidos a un átomo de azufre central. Esta estructura otorga un peso molecular de 98.079 g/mol. La presencia de dos grupos hidroxilo le otorga la característica de ser un ácido diprótico, es decir, puede liberar dos protones en solución (2).

FÓRMULA DEL ÁCIDO SULFÚRICO. Foto de PublicDomainPictures. Pixabay
Origen natural y lluvia ácida
Aunque la mayor cantidad de ácido sulfúrico se produce industrialmente, también se encuentra en la naturaleza. La oxidación de minerales de sulfuro en rocas es una vía natural. Además, cuando el dióxido de azufre se oxida en la atmósfera, especialmente debido a la quema de combustibles fósiles, y se combina con la humedad, se forma ácido sulfúrico.
Este fenómeno lleva a lo que comúnmente se conoce como «lluvia ácida», que puede tener efectos perjudiciales para el medio ambiente, dañando bosques, ríos y lagos y también construcciones hechas por el hombre (3).
Producción industrial
En términos industriales, la producción de ácido sulfúrico implica principalmente el uso del proceso de contacto. Aquí, el dióxido de azufre se combina con oxígeno en presencia de un catalizador, generalmente óxido de vanadio, para formar trióxido de azufre, que luego se hidrata para producir ácido sulfúrico (4).
Propiedades y características
Propiedades físicas del ácido sulfúrico
- Aspecto: Líquido viscoso, generalmente incoloro pero puede tener un tono amarillento.
- Densidad: 1,84 g/ml.
- Punto de ebullición: 337°C.
- Punto de fusión: 10°C.
Concentraciones comunes:
- Ácido de batería: 29-32%
- Ácido de cámara: 62-70%
- Ácido de torre: 78-80%
Propiedades químicas
El ácido sulfúrico es un ácido diprótico fuerte, puede ceder dos protones por molécula en solución acuosa. Es higroscópico, lo que significa que tiende a absorber humedad del ambiente. Su naturaleza ácida lo convierte en un agente oxidante poderoso, permitiéndole reaccionar con varios metales a altas temperaturas. Además, actúa como un deshidratante eficaz, eliminando agua de otras sustancias (5).
Aplicaciones en la industria
El ácido sulfúrico tiene un amplio rango de aplicaciones en la industria:
- Producción de fertilizantes: Una de las principales aplicaciones es en la producción de sulfato de amonio y fosfato, que son fertilizantes clave.
- Industria petroquímica: Se utiliza en refinación de petróleo para eliminar impurezas del petróleo crudo.
- Producción de productos químicos: En la producción de detergentes, pigmentos sintéticos y muchos otros productos químicos.
- Baterías: Es el componente principal de las baterías de ácido-plomo.
- Industria textil: Para decolorar tejidos y también como agente deshidratante (6).
Precauciones y seguridad
El ácido sulfúrico es una sustancia peligrosa y debe ser manejado con extremo cuidado:
- Evitar el contacto directo: Puede causar quemaduras graves en la piel y dañar permanentemente los ojos.
- Producir vapores nocivos: Es esencial trabajar en áreas bien ventiladas y, preferiblemente, con sistemas de extracción de aire.
- Siempre debe ser almacenado en recipientes adecuados y etiquetados correctamente.
- En caso de derrame, se debe neutralizar con un agente alcalino, como bicarbonato de sodio o cal, antes de limpiar.
- El uso de equipo de protección personal (EPP), como guantes resistentes a ácidos, gafas de protección, batas y protectores faciales, es imprescindible cuando se maneja esta sustancia.
- En caso de contacto con la piel o los ojos, lavar inmediatamente con abundante agua durante al menos 15 minutos y buscar atención médica.
- Si se ingiere, no inducir el vómito. Beber agua lentamente y buscar atención médica de inmediato.
- Cuando se diluye, es esencial agregar el ácido al agua y no al revés, ya que esto podría causar una reacción exotérmica violenta que resultaría en salpicaduras y posibles quemaduras (6).
Reacciones del Ácido sulfúrico
El ácido sulfúrico también tiene ciertas reacciones al combinar o mezclar su fórmula. La mezcla entre acrilonitrilo con el ácido sulfúrico concentrado debe mantenerse a muy bajas temperaturas, si no se da esto, puede producir una reacción exotérmica vigorosa.
La combinación del ácido sulfúrico (96%) en porciones iguales con cualquiera de las siguientes sustancias, en un recipiente completamente cerrado; hace que la temperatura y la presión aumente.
Las sustancias combinadas para esta reacción son: acetonitrilo, acroleína, 2-aminoetanol, hidróxido de amonio (28%), anilina, n-butiraldehído, clorosulfónico ácido, etilendiamina, etilenimina, epiclorhidrina, etilcianhidrina, ácido clorhídrico (36%), ácido fluorhídrico (48.7%), formaldehído (40%), hidroperóxido (30%), hipoclorito de sodio solución (10.8%), ácido yodhídrico (48%), mercurio (II) cloruro solución (0.67% Hg), metacrilato de metilo, metil etil cetona peróxido (60%), nitrato de plata solución (2.8% Ag), ácido nítrico (70%), nitriloacético, oleum (65.2% SO3), oleum (9.2% SO3), peróxido de hidrógeno (30%), selenio, sulfuro de sodio, sulfuro de sodio solución, tetraetil plomo, tetranitrometano, ácido vinilsulfónico.
Referencias
- House, J. E. (2016). Química Inorgánica. Elsevier.
- Greenwood, N. N., & Earnshaw, A. (1997). Química de los elementos. Butterworth-Heinemann.
- Seinfeld, J. H., & Pandis, S. N. (2016). Química y física atmosférica: de la contaminación del aire al cambio climático. John Wiley & Sons.
- Bhattacharyya, P. K. (2000). Introducción a la Ingeniería Química. Tata McGraw-Hill Education.
- Atkins, P., & de Paula, J. (2014). Química Física. Oxford University Press.
- Shreve, R. N., & Brink Jr, J. A. (1977). Industrias del proceso químico. McGraw-Hill.