El ácido nítrico o nitrato de hidrógeno cuya fórmula química es HNO3 es un ácido altamente caustico y corrosivo. Es capaz de generar vapores tóxicos que pueden afectar severamente la salud (1).
Este líquido cuenta con una capacidad de descomposición bastante rápida. Se trata de un ácido incoloro y con un olor característico bastante concentrado. Como es sabido, el ácido nítrico actúa como pieza fundamental en la elaboración de químicos o en la industria química, en elaboración de diferentes productos (2).

PRODUCCIÓN DEL ÁCIDO NÍTRICO. Foto de Luvqs. Pixabay
Se emplea en procesos de estudio y en laboratorios por su característica altamente ácida así como en reacciones redox gracias a las propiedades oxidantes del ion de nitrato (3).
Este elemento químico se emplea de forma muy común tanto en los procesos industriales como en los procesos de laboratorio debido a su naturaleza ácida.
El ácido nítrico es utilizado en la fabricación de algunos compuestos químicos tales como el nitrato de amonio, nitrobenceno, ácido adípico, nitrato de potasio, fertilizantes, explosivos entre otros (4).
Está conformado por una masa molecular de 63.01 y contiene una densidad específica de 1.381 y es completamente soluble (5).
Producción de Ácido Nítrico
Dependiendo de la aplicación del ácido nítrico, este se puede conseguir de forma débil o fuerte.
Cuando hablamos de ácido débil, cuyo peso de ácido nítrico es entre 50 – 60 %, es mayormente empleado en la producción de fertilizantes.
Por otro lado, cuando hacemos referencia al ácido fuerte, estamos hablando del ácido que se emplea de forma general en muchas reacciones orgánicas, necesitando para ello una concentración de este componente químico de hasta un 99% en peso (6).
Producción de Ácido Nítrico puro
Para poder lograr el ácido nítrico puro con una concentración al 100% se emplea la reacción que se genera entre el ácido sulfúrico y el nitrato sódico a temperaturas elevadas.
Quedando plasmado de la siguiente forma:
NaNO3 + H2SO4 <–> NaHSO4 + HNO3
El ácido nítrico que se produce, se presenta en forma gaseosa y al desprenderse se desplaza el equilibrio a la derecha.
Estos vapores que se desprenden del ácido nítrico posteriormente se condensan, logrando de esta forma un ácido nítrico líquido y completamente puro.
Producción de Ácido Nítrico Débil
El ácido nítrico débil necesita de tres reacciones químicas que se consideran esenciales en el proceso de producción, a saber:
Oxidación de amoniaco:
El amoniaco en contacto con el aire, reacciona de forma catalítica a una temperatura entre 750 – 800 grados centígrados, produciendo de esta forma, óxido nítrico y agua.
Plasmado en formula de la siguiente manera:
4NH3 + 5O2 = 4NO + 6H2O
Es importante señalar que aparte de la reacción anterior, se generan otras de forma simultanea tales como óxido nitroso y nitrógeno. Esta reacción se presenta cuando las temperaturas son inferiores a las señaladas anteriormente, quedando plasmado en formula de la siguiente manera:
4 NH3 + 3 O2 = N2 + 6 H2O
/ 4 NH3 + 4 O2 = N2O + 6 H2O
Oxidación de Óxido Nítrico:
El hecho de que no se produzca en la etapa anterior, debe ser oxidado a través de la combinación con el aire para poder obtener así dióxido de nitrógeno, quedando plasmado en formula de la siguiente forma:
2NO + O2 = 2NO2
Absorción:
Existen algunos componente que reaccionan de forma exotérmica con el agua desionizada para generar tanto óxido nítrico como ácido nítrico. Estos son el tetróxido de dinitrógeno y el óxido de nitrógeno.
Quedando plasmado en formula química de la siguiente manera:
3NO2 + H2O = 2HNO3 + NO
Propiedades generales del ácido nítrico
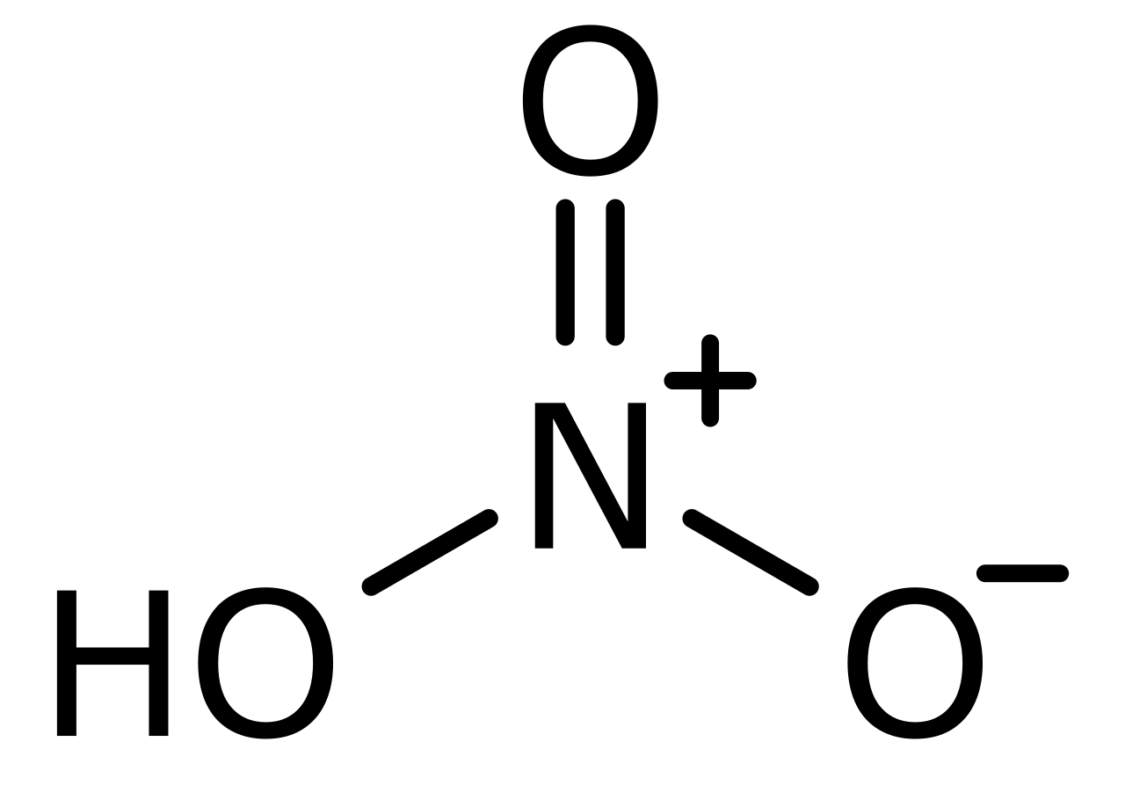
Este componente químico cuenta con diversas propiedades y ventajas de uso que lo hacer característico, entre ellas podemos encontrar:
- Es un líquido incoloro y viscoso (7).
- Cuando se observa algún color en este químico es debido a las impurezas que pueda tener.
- Libera algunos vapores cuando se encuentra a temperatura ambiente.
- Al tener contacto con la piel este componente concentrado, tiende a teñir la piel de un color amarillento.
- Su solubilidad en agua es miscible (7).
- Se trata de un potente agente oxidante (7).
- Al ser mezclado con otros elementos tales como cianuro, polvos metálicos o carburos, puede ser explosivo (8).
- Al ser combinado con un elemento químico como la trementina puede causar una reacción violenta (9).
- Las sales derivadas de este componente químico se denominan nitrato.
- Se trata de un oxácido fuerte (7).
Usos frecuentes
Existe muchos productos que contienen ácido nítrico mayormente se destaca en la industria de carácter químico, debido a su alta capacidad reactiva. Se utiliza con mucha frecuencia para determinar, medir y evaluar algunas reacciones químicas (7). De igual forma, se utiliza para realizar el análisis químico de algunas sustancias.
Por otra parte, el ácido nítrico se emplea con frecuencia en el área farmacéutica. Su empleo es debido a que interviene en la elaboración de algunos remedios o medicamentos tanto en humanos como en animales (9).
Su uso es bastante frecuente en la elaboración de algunos explosivos, gracias a la carga reactiva que posee. Los explosivos diseñados son generalmente aquellos que se emplean en el trabajo de minería, o en la remoción de piedras o materiales grandes y pesados (8).
En este mismo orden de ideas, podemos decir, que en el área agraria, también tiene influencia este agente químico ya que sirve como fertilizante, así como para aligerar las aguas de riego que suelen ser muy pesadas (10).
En el área de la minería es muy común ver a personas utilizar este químico. Esto es debido a su capacidad oxidante y corrosiva (8).
¿Cómo se obtiene el ácido nítrico?
El origen de la obtención de este componente químico se logra a través del óxido nítrico, que a su vez es obtenido a través del amoniaco. Este proceso es mejor conocido como el proceso de Ostwald (7).
El proceso de obtención consiste en hacer pasar una mezcla de amoniaco y aire a través de una red de contacto de platino. La función del platino es catalizadora ya que absorbe los gases en la superficie (7).
Esto facilita el contacto entre los reaccionantes intervinientes. Plasmado a través de formula química de la siguiente forma:
4 NH3 + 5 O2 = 4 NO + 6 H2O K = 10168
2 NO + O2 2 NO2.
El óxido de nitrógeno absorbido se recoge a través de la siguiente forma. Quedando plasmado de la siguiente manera:
3 NO2 + H2O 2 HNO3 + NO
NO2 + NO + H2O 2 HNO2
HNO2 + 1/2 O2 HNO3
Referencias:
- Greenwood, N. N., & Earnshaw, A. (1997). Chemistry of the elements (2nd ed.). Butterworth-Heinemann.
- Jones, A. (2002). Chemistry: Foundations and applications. Gale.
- Lide, D. R. (Ed.). (2009). CRC handbook of chemistry and physics (89th ed.). CRC Press/Taylor and Francis.
- Housecroft, C. E., & Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Pearson.
- Atkins, P., & de Paula, J. (2009). Physical chemistry (9th ed.). Oxford University Press.
- March, J. (1992). Advanced organic chemistry: Reactions, mechanisms, and structure (4th ed.). Wiley.
- Atkins, P., Jones, L., & Laverman, L. (2016). Principios de química: Los caminos del descubrimiento. Editorial Médica Panamericana.
- Urbanski, T. (1983). Chemistry and technology of explosives. Pergamon Press.
- Lide, D. R. (Ed.). (2016). Handbook of chemistry and physics (97th ed.). CRC Press/Taylor and Francis.
- Brady, J. E., & Senese, F. (2016). Chemistry: Matter and its changes. John Wiley & Sons.