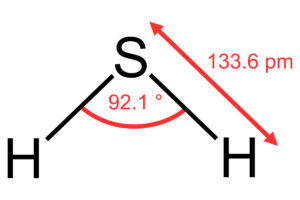
Las causas de la concentración del ácido sulfhídrico son varias. Este ácido puede darse en distintos procesos naturales o artificiales. Su acumulación se debe a su densidad. Pero también ocurre por su generación a altas presiones en el subsuelo, en cámaras o bajo el agua estancada (1).
¿Cuáles son las causas de la concentración de ácido sulfhídrico?
Las causas de la concentración del ácido sulfhídrico dependen de las características del lugar donde se encuentre. Este gas incluso puede llegar a un estado parecido al líquido dentro de cilindros de uso industrial (2).

CAUSAS DE LA CONCENTRACIÓN DE ÁCIDO SULFHÍDRICO. Zbynek Burival. Unsplash
Aire libre
El ácido sulfhídrico suele acumularse en la atmósfera debido a que su densidad es mayor que la del aire. Por eso puede estar en grandes bloques en establos, vertederos de basura, desagües u otros lugares con desechos.
Este ácido se produce por la actividad de bacterias anaerobias en sitios confinados antes de emerger (3). Cuando el lugar donde se genera no puede contenerlo, sube a la superficie y se establece al ras del suelo.
Tuberías y desagües
El ácido sulfhídrico suele acumularse en tuberías, desagües y alcantarillas, especialmente cuando hay obstrucciones. La materia en descomposición, la ausencia de oxígeno y las bacterias anaerobias pueden producir estos gases fácilmente (4).
Debido a su calidez, contribuye a crear un ambiente propicio para las bacterias anaerobias que lo producen. Este gas tiene tendencia a brotar desde el fondo de aguas enrarecidas y sin oxígeno. Al salir a la superficie, se deposita cerca del suelo o de las superficies del agua debido a su densidad.
Industria alimentaria
En la industria alimentaria también se genera ácido sulfhídrico, especialmente durante el almacenamiento de aceite de pescado. Este ácido se acumula debido a que la infraestructura para dispersarlo suele ser costosa. Suele dejarse libre a través de ductos de ventilación (5).
Gases volcánicos
Los gases volcánicos contienen grandes concentraciones de ácido sulfhídrico. Este ácido se acumula en el manto terrestre debido a las grandes cantidades de materia orgánica presentes en él. También se genera por la descomposición del azufre mezclado con agua de ciertas bacterias (6).
El azufre es un elemento abundante en la tierra. Por eso, las bacterias anaerobias del subsuelo tienen grandes cantidades para metabolizar. El ácido sulfhídrico sale por diversos mecanismos del manto terrestre, pero antes se acumula debido a las grandes presiones (7).
Extracción de petróleo y minería
Durante los procesos de extracción de petróleo y minería, se extraen grandes cantidades de ácido sulfhídrico. En las petrolíferas su acumulación se debe a la penetración de capas geológicas donde se encuentra el petróleo.
El petróleo es un combustible proveniente de la descomposición de materia orgánica a altas presiones. Debido a la descomposición, a la total ausencia de oxígeno y a las altas temperaturas se produce en grandes cantidades. Por eso el petróleo viene acompañado de ácido sulfhídrico (8).
Al encontrar un canal para fluir, el ácido sulfhídrico sale con una gran presión de las tuberías que lo contienen. Suele ocurrir así también en las minas. Este gas de invernadero es uno de los muchos que vemos salir en grandes concentraciones por las torres de perforación.
Utilidad para la industria
La concentración del ácido sulfhídrico puede ser inducida sometiéndose a grandes presiones de forma industrial. El gas compactado es introducido en cilindros para su más fácil transporte y almacenamiento.
El ácido sulfhídrico compactado se utiliza en la industria del papel y en la industria textil. También se usa en el envejecimiento de metales y para tratar pieles. En estado compacto, el ácido sulfhídrico es frío y mucho más nocivo que le orgánico.
Referencias:
- Gray, N. F. (1994). Anaerobic digestion and gas production. Biomass Energy, 13(1), 73-83.
- Speight, J. G. (2014). The chemistry and technology of petroleum (5th ed.). CRC press.
- Fenchel, T., & Finlay, B. J. (2008). Oxygen and the spatial structure of microbial communities. Biological Reviews, 83(4), 553-569.
- Johnson, D. B. (2014). Recent developments in microbiological approaches for securing mine wastes and for recovering metals from mine waters. Minerals, 4(2), 279-292.
- Foss, P., & Østergaard, N. B. (1998). Formation of H2S upon storage of fish meal: influence of temperature, water content and pH. Journal of the Science of Food and Agriculture, 78(4), 584-590.
- Oppenheimer, C. (2003). Volcanic degassing. Journal of the Geological Society, 160(4), 671-683.
- Rudnick, R. L., & Gao, S. (2004). Composition of the continental crust. In Treatise on Geochemistry (Vol. 3, pp. 1-64). Elsevier.
- Speight, J. G. (2015). The desulfurization processes. Environmental Inorganic Chemistry for Engineers, 235-261.