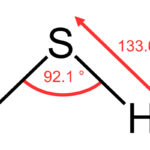
El ácido sulfhídrico, también conocido como “sulfuro de hidrógeno” es un ácido hidrácido que presenta una fórmula molecular (H2S aq) y se encuentra en la naturaleza en diferentes formas. En forma de H2S se encuentra de manera gaseosa y dicho gas es más denso que el aire, es incoloro, muy tóxico odorífero e inflamable(1).
También se encuentra de manera acuosa, y su olor es característico a huevos podridos, siendo un compuesto que desempeña gran importancia para el funcionamiento de nuestro cuerpo.
ÁCIDO SULFHÍDRICO. Foto del dominio público de Wikimedia Commons.
Es importante resaltar que el ácido sulfhídrico se encuentra en disolución acuosa y, al reaccionar con hidróxidos, produce sales más agua. Por ejemplo:
2H2S + 2Be(OH)2 ↔ 4H2O + 2BeS
Como pueden apreciar en esta imagen, el ácido sulfhídrico reacciona con el hidróxido de berilio, y como resultado se tiene el agua y la sal de sulfuro de berilio. La reacción se lleva a cabo en un medio acuoso.
Usos del ácido sulfhídrico
Existen muchos usos de este compuesto químico; desde la industria de la medicina, como en la fabricación de pinturas. A continuación mencionaremos algunos de sus usos:
- Dentro de la química analítica cualitativa es utilizado para indicar marcha catiónica para la precipitación de col cationes metálicos más pesados, y posteriormente es separado por otros métodos. Dichos precipitados amorfos (no tienen forma específica) tienden a ser negros en su mayoría, solo en algunos casos son de color blanco(2).
- En la industrias de objetos antiguos, orfebrería, es utilizado como envejecedor del bronce cuando se conjuga con la sal sulfuro de sodio (Na2S) podemos envejecer (candados, cofres, herramientas). Esa misma sal es utilizado para curtir cueros(3).
- En la industria de la medicina para el desarrollo de nuevos medicamentos es utilizado para lograr la hibernación de ratones, y de esta manera, estudiar los fármacos de mejor manera utilizando sulfhídrico(4).
- En el caso de algunas pinturas en base a carbonato de plomo es el ácido sulfhídrico el responsable del ennegrecimiento de estas pinturas debido al sulfuro plumboso, también conocido como (sulfuro de plomo II) (PbS). Este sulfuro es de color negro, cuando estos casos se hacen presentes se puede aplicar agua oxigenada (H2O2) también conocida como peróxido de hidrógeno, que hace oxidar el sulfuro plumboso (PbS) a sulfato de plomo (PbSO4), y dicho compuesto es de color blanco; siendo este un compuesto de partida para algunas reacciones de síntesis orgánicas(5).
Otros usos del ácido sulfhídrico
- Esta demostrado que el ácido sulfhídrico es un veneno para las plantas y animales cuando se disuelven en agua, pero en estudios recientes con una dosis muy pequeña como (1 parte por 1000 millones) puede trabajar como un precursor en la velocidad de crecimiento de los mismos(6).
- Es un precursor para obtener sales cuando se combina con bases fuertes; dichas sales son muy utilizadas(7).
- Dentro de la industria química en el estudio de reacciones para analizar y determinar la composición de otros elementos en los diferentes materiales y compuestos(7).
- Para la producción de azufre en la industria petroquímica y la industria química, conocido como un proceso llamado (Claus) la cual trabaja con una unidad de recuperación del sulfuro de hidrogeno. En este proceso se combina el ácido sulfhídrico H2S con el dióxido de azufre y posteriormente, en tres etapas catalíticas las cuales son conocidas como recalentamiento, catalización y condensación. Es convertido como azufre básico, este método es muy utilizado alrededor del mundo; este método permite reducir hasta un 96% de azufre y de esta manera se reduce la contaminación(7).
- Se utiliza en la industria petrolera. El petróleo contiene azufre y al mezclarlo con las moléculas de hidrógeno, forman el ácido sulfhídrico, y dicho ácido es utilizado para la refinación del crudo. Esto permite la eliminación de azufre y un contenido menos de azufre aumenta la calidad y a su vez, el valor del petróleo(7).
- Para obtener agua pesada en grandes cantidades, por medio de un proceso conocido como GIRDLER(7).
Propiedades y características del ácido sulfhídrico

A continuación te damos a conocer tanto las propiedades físicas como químicas:
Propiedades físicas:
Peso molecular: 34.1 g/mol(8)
Punto de fusión: 187 oK (-86 oC) (8)
Punto de Ebullición: 213oK (-60 oC)(8)
Propiedades químicas:
Acidez: 6.89 pKa(8)
Solubilidad en agua: 0.33 g/ml (8)
Momento dipolar: 0.97 D(8)
Características que presenta el ácido sulfhídrico
- El ácido sulfhídrico se caracteriza por su olor particular a huevo podrido, u olor de alcantarilla, este olor se debe a la descomposición de la materia orgánica que contenga azufre (9).
- Es un compuesto con un alto grado de oxidación, lo cual reacciona con muchos elementos metálicos tales como el hierro, cobre, acero y latón (9).
- Es un gas incoloro, ligeramente soluble en agua e inflamable(8).
- Cuando se disuelve en agua el olor característico de huevo podrido se pierde (9).
- Comúnmente reacciona como un agente reductor (10).
- En unión de óxidos metálicos y peróxidos hace combustión (10).
- Al contacto con difloruro de oxígeno, genera explosión al contacto con esta sustancia. Cuando está en contacto con trifloruro de cloro y pentafloruro de bromo, también lo hace. Otro compuesto que produce explosión en contacto con ácido sulfhídrico es al cobre en polvo (10).
- En presencia de óxidos metálicos, peróxidos, tales como peróxido de bario, trióxido de cromo y dióxido de plomo, hace combustión (10).
- Al reaccionar con las bases produce desprendimiento de energía emitida en forma de luz o calor (10).
- Cuando pasan por una tubería de hierro oxidada, puede encenderse (10).
- Si está expuesto al medio ambiente, se transforma en dióxido de azufre y ácido sulfúrico, generando la lluvia ácida(11).
Dónde se encuentra el ácido sulfhídrico
- Existen muchas fuentes donde se encuentra el ácido sulfhídrico en la naturaleza como por ejemplo en el gas natural, petróleo, gases volcánicos y en las aguas termales, en los pantanos, aceites de pescado, en los barcos pesqueros y en los alcantarillados (9).
- Otra forma de encontrar ácido sulfhídrico se debe a la degradación bacteriana de la materia orgánica en condiciones anaeróbicas, el causante del gas causado en las alcantarillas, siendo uno de los causantes de los malos olores (9).
- En la industria química es tratado este gas con procesos de desodoración, utiliza los gases con aminas y también, nitrato de calcio en las aguas residuales (9).
- Es un ácido extremadamente nocivo para la salud, solo se necesitan de 20-50 ppm (partes por millón) para causar un daño y malestar agudo que puede causar asfixia, problemas respiratorios agudos, y en algunos casos la muerte por sobreexposición, por su alto grado de toxicidad esta entre los más tóxicos, incluso por debajo de ácido cianhídrico (HCN) (12).
- También se ha encontrado en algunas proteínas sulfuradas, como las cistina y la cisteína se degrada de manera fácil cuando esta en un pH ácido, produciendo ácido sulfhídrico (10).
- En los estanques de buques pesqueros (9).
- También se encuentra en la industria de la minería, utilizado para la degradación de reactivos de flotación a bases de sulfuro, utilizado en la minería de oro (9).
- Los cueros que han sido tratados para el encurtido (9).
- Para plantas de galvanizado se utiliza para tratar las piezas metálicas (9).
- En los volcanes marinos donde hay un continuo flujo de lava, esta presenta material sulfurado que al combinarse con ácido carbónico producen ácido sulfhídrico (9).
- Las plantas que se obtienen con tratamientos de agua (H2O) residuales (9).
¿Cómo se puede obtener el ácido sulfhídrico?

El ácido sulfhídrico se puede obtener al reaccionar el (HCl) ácido clohidrico con sulfuro de hierro, también conocido como sulfuro ferroso, otra manera de producir este ácido es calentar parafina con azufre solido elemental (10).
En la industria, el sulfhídrico es un subproducto de la limpieza del gas natural o de biogás, en los cuales suele existir con contenidos de hasta 10% (9).
Este tipo de ácido puede determinarse por su olor a huevo podrido, como también una mancha de color negro en papel por el sulfuro de plomo PbS impregnado con Pb(CH3COOH) acetato de plomo dando como resultado la siguiente reacción
Pb(CH3COO)2 + H2S → PbS + 2 CH3COOH
Efectos secundarios del ácido sulfhídrico
La exposición al ácido sulfhídrico puede llegar a ser letal (12).
- Una alta exposición de gases de ácidos sulfhídrico pude ocasionar problemas intestinales cuando se inhalan estos gases, pueden ocasionar inflamación en la vías respiratorias (12).
- En las concentraciones aproximadas de 25 ppm (partes por millón) en el aire puede causar síntomas como la falta de aire, tos, dolores en la garganta, irritación nasal, fatiga, pérdida de apetito, dolores de cabeza, irritabilidad, mareos, problemas de memoria y balance (12).
- La exposición crónica a bajos niveles de ácido sulfhídrico causa fatiga, pérdida de apetito, dolores de cabeza, irritabilidad, pérdida de memoria y alteraciones en la función pulmonar (12).
- Una concentración de 100 ppm es inmediatamente peligrosa para la vida y salud, mientras que concentraciones de 500-1000 ppm son letales en una exposición de 30 minutos a una hora (12).
Tratamiento ante exposición al ácido sulfhídrico
- Si una persona es expuesta al ácido sulfhídrico, es importante llevarla a un lugar aireado de inmediato (12).
- Retirar la ropa contaminada y lavar toda la piel expuesta con agua y jabón (12).
- Si la persona no está respirando, se debe administrar respiración artificial (12).
- En caso de que los ojos estén irritados, lavar con agua corriente durante 15 minutos (12).
- Es esencial llamar a emergencias médicas si la exposición es grave (12).
Referencias:
- WHO. (2003). Hydrogen sulfide: human health aspects. World Health Organization.
- Harris, D. C. (2015). Exploraciones cuantitativas en química analítica. Cengage Learning.
- Robinson, T. (2018). The organic constituents of higher plants: their chemistry and interrelationships. Routledge.
- Blackstone, E., Morrison, M., & Roth, M. B. (2005). Hydrogen sulfide induces a suspended animation–like state in mice. Science, 308(5721), 518-518.
- Eastaugh, N., Walsh, V., Chaplin, T., & Siddall, R. (2008). Pigment Compendium: A Dictionary and Optical Microscopy of Historic Pigments. Elsevier.
- Kimura, H. (2011). Hydrogen sulfide: its production, release and functions. Amino acids, 41(1), 113-121.
- Speight, J. G. (2015). Handbook of petroleum product analysis. John Wiley & Sons.
- CRC Handbook of Chemistry and Physics”, 91st Edition, CRC Press, Boca Raton, Florida.
- Grant, W. M. (2004). Toxicology of the Eye. Springfield: Charles C. Thomas.
- Greenwood, N. N., & Earnshaw, A. (1997). Chemistry of the Elements. Butterworth-Heinemann.
- Seinfeld, J.H.; Pandis, S.N. (2006). Atmospheric Chemistry and Physics: From Air Pollution to Climate Change. Wiley.
- National Institute for Occupational Safety and Health (NIOSH). (2016). Hydrogen Sulfide. Centers for Disease Control and Prevention.
Descubre mucho más sobre el ácido sulfhídrico
- ÁCIDO SULFHÍDRICO » Usos, propiedades y efectos secundarios
- Reacción al Respirar Ácido Sulfhídrico » Riesgos y Lugares
- Riesgos por Inhalación de Ácido Sulfhídrico » Prevención
- ¿Cómo Reconocer el Olor al Ácido Sulfhídrico? » Características
- Causas de la Concentración de Ácido Sulfhídrico » Factores
- Ácido Sulfhídrico en la Piel » Exposición y Riesgos
- Enfermedades que Beneficia el Acido Sulfhídrico » ¿Cuáles son?
- Ácido Sulfhídrico en el Medio Ambiente » Orgánico
- Usos del Ácido Sulfhídrico » Aplicaciones Industriales
- Toxicidad del Ácido Sulfhídrico » Síntomas, Peligros y Recomendaciones
Además de toda la información sobre el ácido sulfhídrico, quizá te interese:
Ácidos y su forma corrosiva
No es un secreto ni nada nuevo que debemos tener mucho cuidado al utilizar los ácidos. Así como el ácido sulfhídrico, tenemos diferentes componentes químicos que pueden ser dañinos para nuestra salud si los tocamos o inhalamos de manera inadecuada. Entre las contraindicaciones del ácido clavulánico encontramos la coloración amarillenta de la piel y los ojos, además de dolor estomacal y dificultad para respirar.
Síntomas similares a cuando se toma el magnesio, para poder tomar de forma correcta una dosis de sulfato de magnesio, debemos saber que la cantidad máxima es de 200 gramos por persona, esta disuelta en agua. Lo que producirá trabajos intestinales moderados. Por ello es utilizado para personas con problemas de estreñimiento. Una dosis más alta puede tener problemas de diarrea y vomito.
Cuando hacemos limpieza de los muebles de madera, debemos aprovechar los beneficios del ácido oxálico, ya que trabaja como “blanqueador” de la madera. Pero debemos tener cuidado con su uso directo, puede ser corrosivo para la piel, causando alergias y picazón.
Ácido necesarios
Es importante tomar en cuenta que a veces usamos ácidos sin darnos cuenta; así como sin saber usamos el ácido sulfhídrico en productos de limpieza de metales. Otro ejemplo sencillo es la crema solar, sin darnos cuentan estamos poniendo en nuestra piel las propiedades del ácido benzoico; las cuales también sirven para dar aroma a ciertos perfumes.
En las granjas se suelen aprovechar las propiedades del ácido láctico, ya que se usa mucho en la fabricación de pinturas, pero también en repelentes contra mosquitos, los cuales suelen aparecer en este tipo de hábitat.
Luego en la cosmética también se utilizan diferentes ácidos. El efecto peeling o de limpieza facial de las células muertas, se hace gracias al ácido glicólico que utiliza la cosmética. Puedes ver todos sus beneficios en la web: https://www.todoellas.com/hogar/acido-glicolico/
Quizá te interese:
- La fórmula del ácido carbónico es H2C03 y se utiliza para dar el efecto refrescante de la cerveza y las bebidas gaseosas.
- El ácido fólico se encuentra en alimentos como: frijoles, espárragos, guisantes y trigo. Nos proporciona vitamina B.
- La fórmula del ácido acético C2H402, se utiliza mucho para la fabricación de plásticos y metales.
- Para el control de plagas de hormigas, se utiliza el ácido bórico. Puedes encontrar formas de uso y propiedades en:
https://www.todoellas.com/hogar/acido-borico/. - Algunas veces estas quemaduras, a gran escala, pueden transmitir cambios en los genes hereditarios, de lo cual se encargan los ácidos nucleicos.