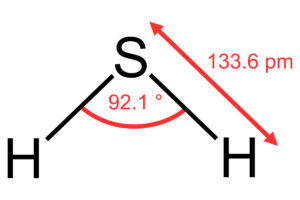
Los usos del ácido sulfhídrico son extensos, puestos que sus aplicaciones van en el área industrial. Por lo general con otros productos químicos. Pocas serán las ocasiones en donde se verá al químico interactuando en el cuerpo humano, se puede decir que hasta nulas. Puesto que es alta la toxicidad que presenta el ácido sulfhídrico(1).
Pero dentro de los diferentes usos que se le da al ácido sulfhídrico que son más comunes, engloban aquellos en donde se da la producción de azufre.

USOS DEL ÁCIDO SULFHÍDRICO. Pixabay. Pexels
Usos del ácido sulfhídrico
El ácido sulfhídrico tiene mala reputación debido a su mal olor y a su toxicidad(1). Pero en la industria ha logrado ganarse un lugar debido a su utilidad en el procesamiento de papel y la orfebrería. Actualmente, se está experimentando con otros usos en la alimentación y la salud humana.
Procesamiento de pulpa y papel
El ácido sulfhídrico es utilizado para reducir la madera a pulpa. También se utiliza para inducir procesos de oxidación en los que el oxígeno elimina sustancias indeseables. Estas sustancias suelen incluir pigmentos y componentes de la madera distintos a la celulosa(2).
Orfebrería y tratado de cueros
El ácido sulfhídrico junto con el sulfuro de sodio se usa para envejecer bronce. Con él puede dársele al bronce un color un tanto desigual y mellado que resulta muy atractiva en el mercado. La sal obtenida del ácido sulfhídrico y el sulfuro de sodio también se usa para curtir cuero(3).
Fabricación de azufre
El ácido sulfhídrico se usa para producir ácido sulfúrico y azufre elemental. Lo utilizan también para crear hidrosulfuro de sodio, sulfuro de sodio y otros sulfuros inorgánicos. Todos estos químicos se usan en pesticidas, tratamiento del cuero y tintes(4).
Experimentación con animales de laboratorio
El ácido sulfhídrico recientemente se ha usado para inducir un estado de hibernación en ratones a través de la hipotermia. En este estado, los científicos pueden analizar las funciones cerebrales bajo la hipoxia(5).
Acelerador del desarrollo de las plantas
El ácido sulfhídrico en pequeñas cantidades puede ayudar a que las plantas germinen muchos más rápido de lo convencional. También puede aumentar el proceso de foliación y servir a su vez como pesticida. Este uso del ácido sulfhídrico puede tener aplicaciones muy útiles en la agricultura(6).
Conservación de alimentos
La conservación de alimentos puede realizarse a través de ácido sulfhídrico, hidrógeno y helio. Este tipo de conservación resulta beneficiosa porque retrasa la maduración y posterior deterioro de los alimentos. Además, permite la conservación de sus características de sabor, color y olor.
Fabricación de pintura negra y blanca
Tras añadir ácido sulfhídrico a pinturas con base de carbonato de plomo, estas pueden volverse negras. Si a la pintura se le añade agua oxigenada, se puede oxidar y volverse blanca. A través del compuesto resultante, pueden obtenerse reacciones de síntesis orgánicas(7).
Pesticidas
Otra de las aplicaciones que tiene el ácido sulfhídrico es como pesticida. Los pesticidas con ácido sulfhídrico aumentan la producción de azufre en los hongos. Esto los destruye sin afectar el funcionamiento de las plantas(6).
Método de Geib-Spevack
A través de este método se pueden crear cantidades industriales de agua pesada para reactores nucleares. El proceso incluye el ácido sulfhídrico para cargar el agua de deuterio en un 99%. De esta manera, el agua puede actuar como moderados nuclear(8).
Alimentación humana
Pequeñas cantidades de ácido sulfhídrico pueden ser muy beneficiosas para la salud. Alimentos como los lácteos y las carnes de res, de pollo y de cerdo lo contienen. También puede contenerlo el ajo, siendo el ácido sulfhídrico uno de los principales reguladores de la presión arterial(9). Estudios realizados por varios comités de la OMS indican que el ácido sulfhídrico puede contribuir al tratamiento contra el Alzheimer. Esto se debe a que ayudan a combatir el olvido y los estados de confusión(10).
Desarrollo de medicamentos cardiovasculares
Aunque actualmente está en desarrollo, se ha logrado aislar el ácido sulfhídrico del ajo para usarlo con fines terapéuticos. Con el ácido sulfhídrico se pretenden tratar enfermedades del sistema circulatorio relacionadas con el endurecimiento arterial(9).
Producción de ácido sulfhídrico de manera natural

Ya sabemos cuales son los uso del ácido sulfhídrico. Ahora una interrogante que puede surgir, es de dónde sacan el ácido sulfhídrico, o cuales son las formas de conseguirlo de manera natural.
Puede comenzarse acotando que en el área petrolera esta se encuentra de manera natural en el crudo(1). De la misma forma, es común conseguir la producción de ácido sulfhídrico de manera natural en aquellos yacimientos de agua residuales. Como pantanos de lodo en donde exista una descomposición de materia orgánica(11).
Además, si se quiere ir más lejos, este también está presente en la lava, y gases que emanan los volcanes(12).
Exposición al ácido
Siendo variados los usos del ácido sulfhídrico quiere decir que pueden ser muchas las personas que estén propensas a una exposición al ácido sulfhídrico. Por lo que conocer en que trabajos se emplea puede ayudarle a crear medidas de protección contra el compuesto.
Por lo general, las exposiciones al ácido sulfhídrico más común son aquellos trabajadores del a empresa petrolera y agricultores. Además de aquellos que se encargan de la limpieza del alcantarillado(13).
Riesgo de exposición al ácido
Ya hablamos sobre cómo puede ser peligrosa la exposición del ácido sulfhídrico. Sin embargo, ciertas condiciones pueden hacer que se presenten riesgos de exposición al ácido sulfhídrico. Es decir, aumentan los peligros que puedan existir.
Dentro de los riesgos de exposición del ácido sulfhídrico pueden presentar en espacios cerrados, en donde no exista una fluctuación constante de oxígeno, sitios con altas temperaturas, e y espacios naturales como pantanos, son aquellos que deben de evitarse, o tener ciertas precauciones por sobre el resto(11).
Peligros del ácido sulfhídrico
Debe aprender a identificar como el gas, y este posee un aspecto incoloro, con un peculiar olor a huevos podridos, por lo que puede ser fácil el identificar dicha componente, que se vuelve peligroso en altas proporciones, sobre todo, los peligros del ácido sulfhídrico abarcan la inhalación del mismo(14).
Se pueden notar los efectos del ácido sulfhídrico por la dificultad que se presenta para respirar, además de una sensación de hormigueo en las extremidades, por lo que si usted es propenso a esto, para que evite los peligros del ácido sulfhídrico es preciso que utilicen un equipo de protección como gafas o tapa bocas(15).
Referencias:
- Guidotti, T. L. (1994). Occupational exposure to hydrogen sulfide in the sour gas industry: some unresolved issues. International Archives of Occupational and Environmental Health, 66(3), 153-160.
- Kirk, R. E., & Othmer, D. F. (2007). Kirk-Othmer Chemical Technology of Cosmetics. Wiley.
- Smith, A. M., & Tarrier, N. (2012). Bronze patination: a guide. Crowood.
- Steudel, R. (2003). Chemistry of the non-metals: with an introduction to atomic structure and chemical bonding. Walter de Gruyter.
- Blackstone, E., Morrison, M., & Roth, M. B. (2005). Hydrogen sulfide induces a suspended animation-like state in mice. Science, 308(5721), 518-518.
- García-Mata, C., & Lamattina, L. (2010). Hydrogen sulphide, a novel gasotransmitter involved in guard cell signalling. New Phytologist, 188(4), 977-984.
- Chapman, J. D., & Waters, W. A. (1974). The oxidation of thiols and disulphides by lead dioxide. Journal of the Chemical Society, Perkin Transactions 2(1), 38-42.
- Walter, C. E., & Moseley, F. (1954). The Geib–Spevack (Girdler sulfide) process for the production of heavy water. Journal of Chemical Education, 31(6), 333.
- Benavides, G. A., Squadrito, G. L., Mills, R. W., Patel, H. D., Isbell, T. S., Patel, R. P., … & Doeller, J. E. (2007). Hydrogen sulfide mediates the vasoactivity of garlic. Proceedings of the National Academy of Sciences, 104(46), 17977-17982.
- Whiteman, M., & Winyard, P. G. (2011). Hydrogen sulfide and inflammation: the good, the bad, the ugly and the promising. Expert Review of Clinical Pharmacology, 4(1), 13-32.
- Guidotti, T. L. (1994). Occupational exposure to hydrogen sulfide in the sour gas industry: some unresolved issues. International Archives of Occupational and Environmental Health, 66(3), 153-160.
- Oppenheimer, C. (2003). Volcanic degassing. Geological Society, London, Special Publications, 213(1), 377-401.
- Smith, L. A., & Rumack, B. H. (1990). Hydrogen sulfide poisoning. Journal of Toxicology: Clinical Toxicology, 28(1), 87-100.
- Brenneman, K. A., James, R. A., Gross, E. A., & Dorman, D. C. (2000). Olfactory neuron loss in adult male CD rats following subchronic inhalation exposure to hydrogen sulfide. Toxicologic Pathology, 28(2), 326-333.
- Reiffenstein, R. J., Hulbert, W. C., & Roth, S. H. (1992). Toxicology of hydrogen sulfide. Annual Review of Pharmacology and Toxicology, 32(1), 109-134.