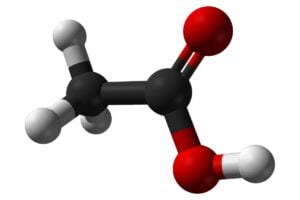
El ácido acético es un compuesto que conocemos mejor por formar parte de un producto que todos utilizamos: el vinagre. De hecho, este ácido es la sustancia que le confiere a este producto, su olor y sabor característicos (1). Allende esta peculiaridad, debes saber que cada año se produce, cuando menos, un millón de toneladas de este ácido (2). De él, y químicamente hablando, se conoce dos formatos, aquí te los vamos a mostrar. Y vamos a hacer de tu conocimiento, la fórmula del ácido acético.
Su volumen de producción y consumo, te alertan acerca de su significación en el mundo hoy. El ácido etanóico o acético se utiliza en algo más que en la sencilla producción de vinagre; se utiliza para mucho más que eso. Por sus propiedades químicas, es sumamente importante en y para, muchos procesos biológicos y también, industriales.

FORMAS DE DILUIR EL ÁCIDO ACÉTICO. Photo by 4339272. Pixabay.
Compuesto químico del Ácido Acético
El ácido acético es un compuesto químico definido como un ácido débil. Esto puede traducirse en que su capacidad de diluirse en agua solo es parcial; es un ácido que en disolución acuosa no alcanza a desleírse totalmente. Paralelamente, está catalogado como una sustancia orgánica, es decir que tiene, cuando menos, un átomo de carbono en su composición. Esta cualidad le confiere propiedades de utilidad indispensable para los seres humanos en múltiples áreas (1).
Resaltemos que tanto las sustancias orgánicas, incluido el ácido acético, como las inorgánicas son parte constante de los sistemas naturales. En estos, desempeñan múltiples funciones: de síntesis y degradación (metabolitos intermediarios) a facilitadores de la estabilización del pH (sistemas tampón) (3). Entonces, podemos decir que el ácido acético tiene diferentes aplicaciones y un amplio espectro de usos tanto en industrias como en el hogar.
¿Qué tipo de compuesto es el ácido acético?
El ácido acético ocupa un lugar sobresaliente en el campo de la química orgánica. Este rol es muy similar al que detenta en la industria, el ácido sulfúrico. Como te hemos comentado, en el entorno de los ácidos, su composición química permite caracterizarlo como un ácido débil. Se origina a partir de procesos de degradación de otras sustancias, que se hacen reaccionar con enzimas (4).
Su punto de fusión es 16,6°C y el de ebullición es 117,9°C. En el presente, el método principal para su elaboración es el método llamado carbonilación. Este procedimiento consiste en hacer reaccionar metanol CH3 con monóxido de carbono CO. Anteriormente, se producía mediante la combinación de etileno C2H4 en acetaldehído C2H4O, por oxidación del C2H4O resultaba ácido acético (2).
El metanol CH3 y el monóxido de carbono CO
El metanol, uno de los componentes del ácido acético, es también conocido como alcohol de madera, metílico o de quemar. En la producción de este ácido, el metano o CH3 interviene comportándose como un reactivo. Es un radical que aunque posee tres átomos de hidrógeno, está centrado en el átomo de carbono.
Por su lado, el monóxido de carbono CO, es el segundo componente del ácido. Originalmente derivado de la quema de combustibles fósiles, es el elemento que hace posible la reacción necesaria con el metanol. De esta reacción química llamada de oxidación, se origina finalmente, el compuesto del que hablamos: el ácido acético.
Fórmula del ácido acético y sus dos formatos
La fórmula molecular del ácido acético es C2H4O2. No obstante, también puede representarse desde el punto de vista de la IUPAC, como CH3COOH que es su fórmula química. La IUPAC, es el organismo que se ha encargado de oficializar mundialmente, las fórmulas de los múltiples compuestos químicos (5). Esta institución, la Unión Internacional de Química Pura y Aplicada (IUPAC por sus siglas en inglés) lo ha denominado como ácido etanóico.
C2H4O2
Para nada está de más recordar que la fórmula molecular es la fórmula que indica el número efectivo de átomos que conforman una molécula. Por su lado, la fórmula química viene a ser la representación aceptada de aquellos elementos que configuran un compuesto químico. Al mismo tiempo, la fórmula química indica los valores (porcentajes) en los que esos elementos que se relacionan (3).
Formas de diluir el ácido acético
El segundo nombre habitual por el cual se reconoce esta sustancia es ácido acético. Vinagre es el doméstico. Pero, en el lenguaje de la química tiene denominaciones más complejas. Es identificada como ácido metilcarboxílico e igualmente como ácido etanóico. En el campo de los ácidos, su composición química lo especifica como un ácido débil(6). Se genera a partir de procesos de degradación de otras sustancias cuando entran en reacción con un catalizador(7).
Como te indicamos, todos lo conocemos por una presentación y uso, de carácter casero. En todo hogar lo identificamos como: el vinagre. Todos lo aprovechamos en la cocina para sazonar algunos alimentos. En ese contexto, hacemos uso de él en dilución acuosa. Su concentración normal varía entre el 3% y el 5%. Si dispusiésemos de él en una dilución con grados mayores, nos valdría más no usarlo. En altas proporciones, es peligroso usarlo en casa(8).
Usos de este ácido
Se usa regularmente en la preparación de varias emulsiones medicinales según pautas populares. En tales preparaciones, puedes usar vinagre con diferentes concentraciones. En ocasiones necesitas hasta con el 70%. Puedes encontrarlo en comercios especializados. Otras veces necesitas una concentración del 3, 5, 7, o 9 por ciento. Para producirlo, debes diluir el ácido que tengas disponible. De este modo, obtienes una dilución acorde con tus fines(9).
El producto con el 70% de esencia acética está compuesto por ácido y agua. En esta proporción, contiene 7 partes de ácido y 3 partes de agua de su volumen total. Con estas proporciones, se encuentra demasiado concentrado y no es conveniente usarlo. Según el caso, puedes emplear el vinagre de mesa, que encuentras en el comercio. Es más fácil de manejar ya porque ya está diluido en una medida concreta.
Existe una razón por la cual puedes crear tu propia dilución de ácido acético, esa razón es su costo. Es cierto, tienes la opción de adquirir el ácido en una dilución ya preparada de fábrica. Pero, si dispones del concentrado, con la cantidad de una cuchara de café, puedes conseguir unos 100 mililitros de vinagre. Lo tienes en la proporción que tu desees y con un costo mucho menos que el vinagre industrial.
Procedimiento
En la campo de la ciencia química, manejar las cantidades de cada elemento a utilizar es una exigencia crucial. Entonces, necesitas precisar la cantidad de ácido y agua que vas a emplear para completar la mezcla. En este contexto, el cálculo de la masa molar tiene una gran significación. Necesitas disponer de esa molaridad (M) del compuesto que usarás. Asimismo, la medida de concentración final de la dilución que requieres.
Ingredientes: ácido acético glacial, 100ml de agua purificada
Agrega muy cuidadosamente, 5 ml de ácido acético glacial a 95 ml de agua destilada y mezcla completamente. Es muy importante que diluyas el ácido acético perfectamente. Si lo empleas sin diluir puede provocarte en la piel, quemaduras químicas que pueden ser graves(10). Recuerda desechar la dilución que no hayas utilizado.
No olvides emplear los equipos de seguridad que son imperiosos a la hora de trabajar con sustancias como los ácidos.
Referencias:
- (1) Silva, M. & Rodriguez, R. (2016). Características y propiedades del ácido acético. Journal of Chemical Reviews, 4(2), 213-221.
- (2) Perez, L. & Martínez, J. (2015). Producción y aplicaciones del ácido acético. Chemical Processes Journal, 19(1), 12-18.
- (3) García, F. (2018). Fórmulas químicas y su representación en la literatura. Journal of Chemistry and Education, 7(3), 102-109.
- (4) Sanchez, R. & Torres, L. (2017). Degradación y síntesis de ácidos. Journal of Chemical Synthesis, 3(2), 98-105.
- (5) IUPAC. (2019). Nomenclature and Representation of Chemical Compounds. IUPAC Recommendations.
- (6) McMurry, J. (2012). Química Orgánica (8va ed.). Cengage Learning.
- (7) Carey, F. A., & Sundberg, R. J. (2007). Advanced Organic Chemistry Part A: Structure and Mechanisms (5ta ed.). Springer.
- (8) Lide, D. R. (Ed.). (2009). CRC Handbook of Chemistry and Physics (90ta ed.). CRC Press/Taylor and Francis.
- (9) Solomons, T. W., & Fryhle, C. B. (2009). Química Orgánica (10ma ed.). John Wiley & Sons.
- (10) Brown, T. E., LeMay, H. E., Bursten, B. E., & Murphy, C. J. (2017). Chemistry: The Central Science (14ta ed.). Pearson.