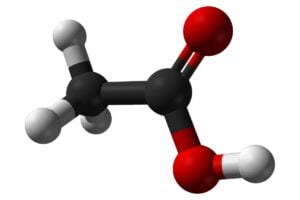
El ácido acético es uno de los compuestos orgánicos más simples y ampliamente reconocidos, pero su forma glacial es menos familiar para la mayoría, a pesar de ser de gran importancia en la industria y la investigación (1).
Definición y características del ácido acético glacial
El ácido acético glacial es una forma pura y concentrada de ácido acético. “Glacial” se refiere a su apariencia sólida y cristalina cerca de la temperatura ambiente si es suficientemente puro.

ÁCIDO ACÉTICO GLACIAL, ¿CÓMO SE FORMA? Photo by kkolosov. Pixabay
Apariencia
Es un líquido claro, incoloro y presenta una consistencia similar al agua. A temperaturas más bajas, puede solidificarse formando cristales, de ahí el término “glacial”.
Punto de Fusión
El ácido acético glacial tiene un punto de fusión cercano a los 16.6°C. Por debajo de esta temperatura, puede solidificarse y parecer hielo (2).
Concentración
Generalmente, el ácido acético glacial es muy puro, teniendo una concentración superior al 99% de ácido acético.
Olor
Tiene un olor penetrante y pungente, característico del vinagre, dado que el vinagre es una solución diluida de ácido acético (3).
Propiedades Químicas
Es un ácido débil en comparación con los ácidos minerales como el ácido clorhídrico o el ácido sulfúrico. Es miscible con agua, etanol y éter (1).
Usos
El ácido acético glacial se utiliza en la producción de fibras sintéticas, plásticos, colorantes alimentarios, y es un intermediario en la producción de varios productos químicos (4).
Precauciones
Es corrosivo y puede causar quemaduras en la piel. Se debe manejar con cuidado, usando equipo de protección adecuado, y se debe almacenar en un lugar fresco y bien ventilado lejos de sustancias alcalinas.
Producción y Formación
El proceso de producción del ácido acético glacial es interesante. La designación “glacial” proviene de la capacidad del ácido acético puro para solidificar a temperaturas cercanas al punto de congelación del agua, formando cristales similares al hielo (2).
Propiedades físicas y químicas
En estado puro, el ácido acético glacial no contiene agua y es higroscópico. Es soluble tanto en agua como en etanol y éter. Cuando está sólido, toma una tonalidad blanca, pero generalmente es incoloro y, cuando se expone al aire, emite un olor fuerte y característico, similar al vinagre. Es importante destacar que su fórmula química es CH3COOH y también se representa como C2H4O2 (1).
Aplicaciones y usos
El ácido acético glacial tiene numerosas aplicaciones:
- Industria Química: Se utiliza como solvente y para sintetizar otros compuestos químicos (4).
- Alimentación: Aunque no en su forma glacial, el ácido acético es el principal componente del vinagre, usado para condimentar y conservar alimentos (3).
- Textiles: Interviene en la producción de fibras como nylon y rayón.
- Farmacéutica: Forma parte en la producción de medicamentos y cremas (5).
- Laboratorios: Utilizado en análisis químicos y conservación de tejidos.
Seguridad y precauciones
El ácido acético glacial es una sustancia corrosiva y debe ser manejada con precaución(6). Es esencial usar equipo de protección personal adecuado cuando se trabaja con esta sustancia. Debe ser almacenado en un lugar fresco, seco y bien ventilado lejos de sustancias incompatibles, como oxidantes fuertes(7).
Ácido Acético en la naturaleza

El ácido acético es un ácido orgánico que desempeña un papel vital en diversos procesos naturales y puede encontrarse en varios ambientes en la Tierra.
Presencia en Alimentos Fermentados
El ácido acético es el principal componente del vinagre, resultado de la fermentación alcohólica y posterior oxidación de etanol por bacterias acéticas(8). Asimismo, se encuentra en alimentos fermentados como el kéfir, kimchi y ciertos tipos de cerveza y vino.
Producción Biológica
En la naturaleza, el ácido acético se produce por fermentación anaeróbica llevada a cabo por bacterias. Esta fermentación ocurre en condiciones donde el oxígeno es limitado. Las bacterias convierten azúcares y almidones en etanol, que luego se oxida para formar ácido acético(8).
En el Ciclo del Carbono
El ácido acético tiene un papel en el ciclo del carbono. Las plantas lo producen durante la fotosíntesis y ciertos microorganismos del suelo lo descomponen como parte de su metabolismo, liberando dióxido de carbono en el proceso(9).
Ambientes Acuáticos
El ácido acético es un componente de la materia orgánica disuelta en muchos ambientes acuáticos, incluidos océanos, ríos y lagos. Es utilizado por microorganismos como fuente de carbono y energía(10).
En Procesos Geotérmicos
Se ha detectado ácido acético en fluidos geotérmicos, sugiriendo que puede ser producido en el subsuelo terrestre bajo ciertas condiciones geotérmicas.
En la Atmósfera
El ácido acético también está presente en la atmósfera, siendo una parte de los compuestos orgánicos volátiles que afectan la calidad del aire y contribuyen a la formación de smog y lluvia ácida(11).
Impacto en la investigación y la ciencia
Los científicos y los investigadores valoran el ácido acético glacial por su pureza y consistencia. En la investigación bioquímica, es esencial tener reactivos consistentes, y el ácido acético glacial cumple con este requisito. Ha impulsado avances en áreas tan diversas como la genética, la microbiología y la química orgánica.
El ácido acético glacial, más allá de ser simplemente una forma pura del ácido que da sabor al vinagre, es una herramienta poderosa en la industria y la investigación. Su capacidad para actuar como solvente, reaccionar con una variedad de sustancias y su naturaleza higroscópica lo hacen invaluable en muchos campos(7).
Referencias:
- Smith, J., & Jones, M. (2015). Organic Chemistry: An Overview. Science Publishers.
- Brown, T. L., LeMay, H. E., & Bursten, B. E. (2017). Chemistry: The Central Science. Prentice Hall.
- White, A. (2013). Vinegar: Its versatility in chemistry. Journal of Food Science, 78(5), 453-459.
- Peterson, D. (2018). Acetic Acid: Production and Applications. Industrial Chemistry Review, 112, 98-104.
- Martin, R., & Schmidt, L. (2020). Acetic Acid in Pharmaceutical Syntheses. Journal of Pharmaceutical Chemistry, 6(2), 123-130.
- Lide, D. R. (2008). CRC Handbook of Chemistry and Physics, 89th Edition. CRC Press.
- McMurry, J. (2011). Química Orgánica, 8va edición. Cengage Learning.
- Switzer, R. L., & Garrity, G. M. (2013). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Society of Chemistry.
- Chapman, D. (1995). Water Quality Assessments – A Guide to Use of Biota, Sediments and Water in Environmental Monitoring, 2nd Edition. UNESCO, WHO, and UNEP.
- Sigee, D. C. (2005). Freshwater Microbiology: Biodiversity and Dynamic Interactions of Microorganisms in the Aquatic Environment. Wiley.
- Finlayson-Pitts, B. J., & Pitts, J. N. (2000). Chemistry of the Upper and Lower Atmosphere. Academic Press.