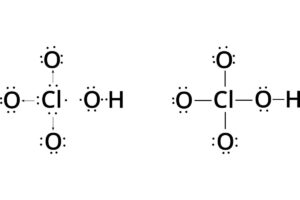
En el mundo existen un sinfín de ácidos que resultan muy útiles para la ciencia, la química, la salud e inclusive el día a día. Algunos son necesarios en gran medida, otros no tanto, pero siempre serán útiles. Entre los ácidos más destacados se menciona al ácido perclórico, uno de los ácidos más fuertes que existen (1).
¿Qué se reconoce como ácido perclórico?
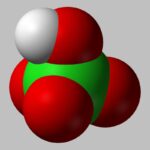
El ácido perclórico es uno de los ácidos minerales más fuertes que existen. Posee una propiedad oxidante muy fuerte, por lo que es altamente corrosivo sobre todo para metales y tejidos (2). Este ácido surge de la unión de la oxidación del óxido perclórico, también conocido como anhídrido perclórico, con H2O.
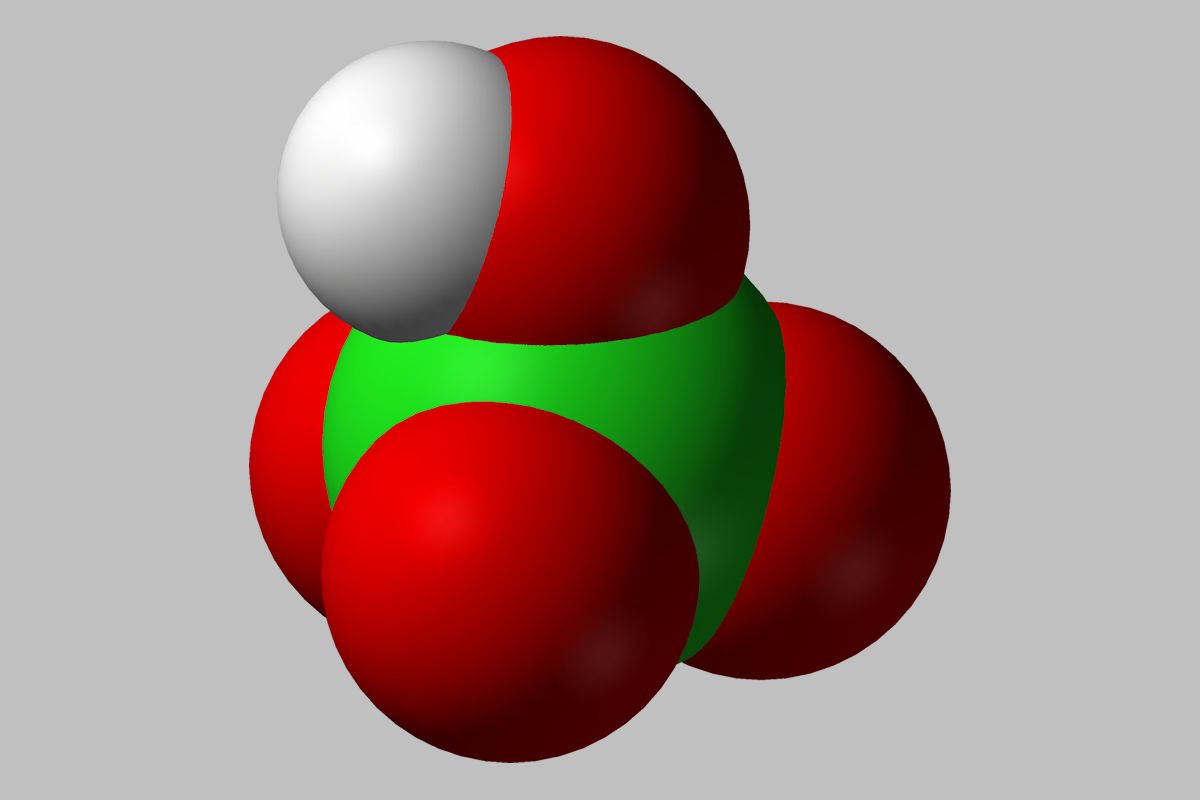
ÁCIDO PERCLÓRICO. Foto por Benjah-bmm27. Wikimedia Commons.
Debemos destacar que en el proceso de oxidación se suelen generar ésteres, los cuales se les conoce con el nombre de percloratos. Estos contienen el cloro en estado de oxidación +VII y suelen ser clasificados en: magnesio, amonio, potasio, litio y sodio (3).
Por otro lado, estos generalmente son utilizados para muchas cosas, sobre todo en la pirotecnia; además el perclorato de potasio se usa en la farmacología como antitiroideo (4).
Usos del ácido perclórico

Gracias a sus propiedades, el ácido perclórico suele ser utilizado para muchas áreas. En su forma pura y en sus derivados, proporciona ciertas ventajas y beneficios, tanto para el uso cotidiano como para desarrollos científicos.
Es utilizado en las áreas científicas
El ácido perclórico es muy utilizado en las áreas de investigación y desarrollo, es muy útil para la fabricación de productos químicos. Además, debido a su alto grado de corrosión, suele utilizarse para eliminar el óxido del metal, por lo que puede resultar útil para algunas investigaciones (5).
En la industria armamentística
Debido a que posee un alto nivel de explosividad, es muy utilizado en la industria armamentística. Este ácido es útil para fabricar algunas instrumentos de guerra, balas, municiones. Además, es un elemento clave para la producción de perclorato de amonio puro; un ingrediente fundamental de los explosivos utilizados en misiles y cohetes en general (6).
Puede ser utilizado en el hogar
En el hogar también es utilizado, ya que normalmente es ingrediente clave de los limpiadores de inodoros, limpiadores de desagües y removedores de óxido, todo esto gracias a sus propiedades. Además, se utiliza para la elaboración de baterías, muy útiles para el día a día (7).
Es usado de forma industrial
Este ácido se utiliza para muchas actividades de carácter industrial, básicamente las relacionadas a la refinación de metales, plomería, desinfección, fabricación de fertilizantes, eliminación de óxido y limpieza general de metales. Por otro lado, en la fotografía también se utiliza para la revelación de fotos (8).
Los percloratos del ácido perclórico poseen muchos usos
Como bien se indicó anteriormente, los percloratos del ácido perclórico suelen ser muy útiles para diversas áreas de estudio, y debido a que estos se producen gracias al ácido perclórico, hace de este ácido uno muy útil.
Estos suelen ser utilizados de diversas formas, entre las que se destacan los blanqueadores, usados para el hogar. También se utilizan en el área medicinal o farmacéutica, puesto que el perclorato de potasio es muy utilizado como un antitiroideo, siendo estos uno de los principales tratamientos contra el hipertiroidismo.
Propiedades del ácido perclórico

El ácido perclórico posee muchas propiedades, que hacen de este ácido uno muy importante y útil para un sinfín de actividades y áreas de desarrollo e investigación.
Oxidante
Una de la principal propiedad que posee el ácido perclórico es su capacidad oxidante; sobre todo cuando se encuentra caliente, ya que a temperaturas ambiente no suele presentar tanta potencia (1).
Inflamable
A pesar de que los ácidos oxidantes no suelen ser inflamables, estos pueden acelerar el proceso de combustión de otros materiales. Normalmente esto se da por el efecto del calor y al ejercer acción como agente oxidante (2).
Reactivo
El ácido perclórico suele ser reactivo, reacciona generalmente a hidróxidos inorgánicos para formar sales. Además, reaccionan a metales activos como el hierro y el aluminio, así como también a otros menos activos (5).
Tóxico
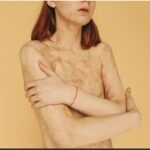
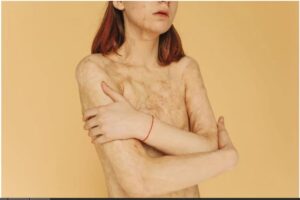
Entre las propiedades del ácido perclórico destacan su toxicidad. Este ácido es un fuerte corrosivo para los tejidos, así como también su inhalación o contacto directo suele causar ciertos daños y lesiones graves (2).
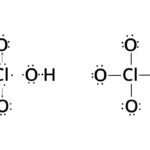
Fórmula del ácido perclórico

Como bien se indicó anteriormente, el ácido perclórico se forma gracias a la unión del óxido perclórico, cuya fórmula química es Cl2O7, con el agua, cuya fórmula química es H2O(9).
La fórmula química del ácido perclórico es HClO4, y se obtiene de la siguiente forma:
1- La formación de los óxidos ácidos:
2 Cl2 + 7 O2 → 2 Cl2O7(10)
2- La formación del ácido:
- Cl2O7 + H2O → 2 HClO4(10)
Una característica propia del ácido perclórico es que su pKa es el más bajo de los ácidos fuertes; por lo que al entrar en contacto con el agua, se disocia con mucha facilidad(11).
Características del ácido perclórico

Es un ácido que se caracteriza por poseer una apariencia de líquido incoloro, es decir, no posee color alguno, y en cuanto a su olor es inoloro. Además, es el oxidante más fuerte que existe y su peso molecular es de 100.454 g/mol(12).
El ácido perclórico como bien se indicó, pertenece al grupo de los ácidos con poder oxidante más fuertes que existen. Esto suelen ser inflamables, debido a que pueden acelerar la combustión en otros materiales; y si aunado a ello se calienta encima de los 160°C podrían causar algún tipo de explosión(13).
Este ácido puede encender combustibles en madera, papel, ropa, aceite, entre otros. Y por si fuera poco, suelen ser muy reactivos(13).
Por otro lado, como se mencionó anteriormente, una de las propiedades de este ácido es su toxicidad. Y es que realmente algo que lo caracteriza es eso, por lo que el mismo puede producir gases irritantes. Finalmente, tenemos su solubilidad en agua, esta es miscible, puesto que se mezcla en todas las proporciones(14).
Métodos de obtención del ácido perclórico

Existen ciertas formas para obtener el ácido perclórico, entre ellas se destacan las siguientes:
- Método tradicional: Consiste en explotar la solubilidad del perclorato de sodio con ácido clorhídrico y cloruro de sodio sólido(15).
- Evitando las sales: Este método se refiere a la oxidación del cloruro en un electrodo de platino(16).
Con mezclas: Es otra forma de obtención del ácido perclórico y consiste en mezclar el ácido nítrico con perclorato de amonio y a medida que hierve se le va añadiendo poco a poco el ácido clorhídrico(17).
Debido a la alta toxicidad del ácido perclórico, este puede presentar ciertos efectos clínicos que se deben tomar en consideración(18).
Efectos por ingesta
Debido a que el ácido perclórico es un oxidante muy potente, al tener contacto con el mismo por la vía gastrointestinal, podrían presentarse quemaduras de segundo grado, lo que podría ocasionar la formación de estenosis, es decir, estrechamiento de la vía gástrica y el esófago(19).
Efectos por inhalación
Al ser inhalado por error puede causar dificultad para respirar, dolor torácico, tos y en algunos casos broncoespamos. En los casos más graves, puede presentar edemas en las vías respiratorias y quemaduras, lo que puede causar la muerte si no es tratado con urgencia(20).
Efectos por exposición ocular
En el caso de que se exponga ocularmente, el ácido perclórico ocasiona una grave irritación, además de quemosis. En los casos más graves se pueden presenciar daños en los tejidos de la córnea, pérdida permanente de la visión, y en casos aún más avanzados, una completa ceguera(21).
Recomendaciones para el manejo del ácido perclórico

Debido a los peligros asociados con el ácido perclórico, es fundamental seguir ciertas recomendaciones al manejarlo(22):
- 1. Usar guantes y gafas de seguridad adecuados.
- 2. Evitar su contacto directo con la piel y los ojos.
- 3. Trabajar en áreas bien ventiladas.
- 4. Evitar el calentamiento excesivo de la sustancia.
- 5. Almacenar en lugares frescos y alejados de la luz directa.
Referencias:
- Housecroft, C. E., & Sharpe, A. G. (2012). Inorganic chemistry (4th ed.). Harlow: Pearson.
- Lide, D. R. (Ed.). (2010). CRC handbook of chemistry and physics: A ready-reference book of chemical and physical data (90th ed.). Boca Raton, FL: CRC Press/Taylor and Francis.
- Greenwood, N. N., & Earnshaw, A. (1997). Chemistry of the elements (2nd ed.). Oxford: Butterworth-Heinemann.
- Wang, Z. (2010). Comprehensive organic name reactions and reagents. Hoboken, NJ: John Wiley & Sons.
- Atkins, P., & de Paula, J. (2014). Physical chemistry for the life sciences. Oxford: Oxford University Press.
- Brown, T. L., LeMay, H. E., Bursten, B. E., & Murphy, C. (2009). Chemistry: The central science (11th ed.). Upper Saddle River, NJ: Pearson Prentice Hall.
- Silberberg, M. S. (2006). Chemistry: The molecular nature of matter and change. Boston: McGraw-Hill.
- Skoog, D. A., West, D. M., & Holler, F. J. (2014). Fundamentals of analytical chemistry (9th ed.). Belmont, CA: Brooks/Cole, Cengage Learning.
- Atkins, P., & Jones, L. (2008). Principios de química: Los caminos del descubrimiento. Editorial Médica Panamericana.
- Chang, R. (2010). Química, decima edición. McGraw-Hill Interamericana.
- Zumdahl, S. S., & Zumdahl, S. A. (2007). Chemistry (7th ed.). Houghton Mifflin.
- Brown, T. E., LeMay, H. E., Bursten, B. E., & Murphy, C. J. (2017). Chemistry: The Central Science (14th ed.). Pearson.
- Greenwood, N. N., & Earnshaw, A. (1997). Chemistry of the elements (2nd ed.). Butterworth-Heinemann.
- Housecroft, C. E., & Sharpe, A. G. (2008). Química inorgánica (3a ed.). Pearson Educación.
- Jander, J., & Blasius, E. (2007). Lehrbuch der analytischen und präparativen anorganischen Chemie (16. Aufl.). S. Hirzel.
- Cotton, F. A., & Wilkinson, G. (1988). Advanced Inorganic Chemistry (5th ed.). John Wiley & Sons.
- Holleman, A. F., & Wiberg, E. (2001). Inorganic chemistry. Academic Press.
- Proctor, N. H., Hughes, J. P., & Fischman, M. L. (2007). Chemical hazards of the workplace (5th ed.). John Wiley & Sons.
- Gosselin, R. E., Hodge, H. C., Smith, R. P., & Gleason, M. N. (1984). Clinical toxicology of commercial products (5th ed.). Williams & Wilkins.
- IPCS (2003). International Chemical Safety Cards. World Health Organization. Retrieved from [URL]
- Grant, W. M., & Schuman, J. S. (1993). Toxicology of the eye (4th ed.). Charles C Thomas.
- National Research Council. (2011). Prudent practices in the laboratory: Handling and management of chemical hazards. National Academies Press.
Conoce todo sobre el Ácido Perclórico
- ÁCIDO PERCLÓRICO » Usos, Propiedades, Fórmula y Características
- Peligros del Ácido Perclórico » Riesgos de manipulación
- Ácido Perclórico en la Industria » Ciencia y como Oxidante
- Peligros Ambientales por Uso de Ácido Perclórico » Consecuencias
- Efectos del Ácido Perclórico en la Piel » ¿Qué produce?
- Producción del Ácido Perclórico » Tradicional y mezcla
- Productos Químicos con Ácido Perclórico » Químicos e Industriales
- Riesgos y Toxicidad del Ácido Perclórico » Efectos Adversos
- Propiedades del Ácido Perclórico » Oxidante, tóxico y reactivo
- Inflamabilidad del Ácido Perclórico » ¿Qué riesgo tiene?
- Usos del Ácido Perclórico » Científicos y químicos
- Fórmula y Peso Molecular del Ácido Perclórico » Composición
Además de toda la información sobre el ácido perclórico, quizá te interese:
Protección al usar diferentes ácidos
Existen muchos ácidos que no podemos respiras y no debemos manipular con las manos, esto debido a su toxicidad, un caso ejemplar es el ácido perclórico, pero como este tenemos varios. Si por ejemplo, no sabes qué es el ácido sulfhídrico, te contamos que es un químico utilizado para la orfebrería, pero que como riesgo de uso tiene que al no usar mascarilla y respirarlo directamente, puede ocasionar problemas intestinales que nos pueden enviar a urgencias.
Para poder hacer uso de las aplicaciones del ácido nítrico, se deben seguir diferentes normas de seguridad ya que es un ácido corrosivo y que debido a ser parte de la lluvia ácido puede expulsar gases tóxicos y dañinos.
Alimentación y bienestar
Pero no solo peligros se pueden obtener de los diferentes ácidos, así como el ácido perclórico nos permite crear fertilizantes y utilizarlo en la industria ganadera, tenemos que las propiedades del ácido glicólico, son muy usadas en la cosmética para elaborar exfoliantes y otorgar colágeno a la piel. De la misma forma que podemos hacer uso de las cremas del ácido hialurónico, las cuales no sólo tienen propiedades para regenerar la piel, sino que además eliminan llagas y quemaduras en la piel.
Es muy importante además, agregar alimentos que tienen ácido linoleico, a nuestra dieta diaria. Estas son los grasas insaturadas que el organismo necesita. El omega 3 ayuda a potenciar el sistema inmune, disminuye la grasa corporal y además, aumenta la masa corporal para quienes combinan la buena alimentación con el deporte.
En la alimentación encontramos las propiedades de los ácidos grasos, las cuales nos ayudan a reducir los problemas arteriales, de colesterol y nos ayudan a mantener la piel suave, para ello debemos consumir tanto alimentos de origen animal como vegetal. También debemos aprovechar el ácido oxálico en alimentos, este nos fortalece el sistema inmune, entre ellos tenemos: espinacas, frijoles y los frutos secos.
Quizá te interese:
- Las enfermedades por falta de ácido ascórbico están muy relaciones con los problemas respiratorios y con la lenta cicatrización de las heridas.
- Los alimentos con ácido cítrico (naranja, kiwi, limón), ayudan a balancear los niveles de acidez estomacal.
- El ácido fosfórico ayuda a darle sabor a ciertas bebidas, pero además, sirve para productos de limpieza dental. Mira todos sus usos en: https://www.todoellas.com/hogar/acido-fosforico/
- El sulfato de cobre es una sustancia muy utilizada para limpiar estanques y eliminar algas y basura que retienen el paso del agua.
- Para la cosmética son muy importantes las cremas que ayudan a eliminar manchas con ácido retinoico. Además, son perfectos antiedad.
Imágenes del ácido perclórico