El ácido fosfórico es un oxácido de fósforo que a pesar de no ser considerado un ácido fuerte, su mal uso o la exposición constante a este químico puede generar daños fuertes a la salud.
Se trata de un ácido mineral donde tres protones ácidos se enlazan al anión de fosfato. El ácido fosfórico se presenta en forma líquida o sólida y es calificado como uno de los ácidos que tiene mayor utilidad, entre la que podemos resaltar como de mayor importancia la de agente fertilizante.

Propiedades del Ácido Fosfórico. Foto por Envato.
Su combinación con potasio e hidrógeno forman parte de los tres principales nutrientes de las plantas. La composición de este ácido y su fórmula molecular hace que pueda reaccionar con diversos hidróxidos dando como origen, diversidad de sales.
Propiedades del Ácido Fosfórico
Propiedades físicas
Entendemos por propiedades físicas que es toda propiedad que puede ser medible. Generalmente, se conoce como el conjunto de propiedades físicas que logran definir el estado de cualquier sistema físico por lo que en algunos casos se les denomina como observables.
Las transformaciones que se generan en las propiedades físicas de un sistema, describen los cambios y evolución entre estados.
Propiedades químicas
Cuando hablamos de propiedad química hacemos referencia a cualquier propiedad de la materia que genera un cambio en la composición.
Toda propiedad química es determinada por ensayos químicos que se relacionan a su vez, con la reactividad de las sustancias químicas que la componen.
Propiedades físicas y químicas del ácido fosfórico
- Su presentación en diferentes estados físicos puede varía de acuerdo a la tempera y pureza del ácido.
- Cuando se expone el ácido fosfórico a 20° C, en una concentración entre el 50 y 70% se transforma en un líquido transparente móvil.
- Si se encuentra en una concentración del 85 %, su consistencia es viscosa, transparente incoloro o con un tono ligero amarillento.
- Si su concentración es al 100% se transforma en cristales ortorrómbicos.
- Carece de olor.
- Cuenta con un punto de ebullición de hasta 213 °C.
- Su punto de fusión es de 42.35 °C.
- Cuenta con una densidad específica de 1.8741 g/cm3 a 25 °C.
- Su pH es de 1.5.
- Su solubilidad es efectiva en agua caliente, bajo temperaturas que oscilan entre 548 g/100 mL)
- Cuenta con una presión de vapor a 20 °C de aproximadamente 4 Pa.
- Se puede transformar en tres tipos de sales, a saber: fosfatos tribásicos, dibásicos, y primarios.
- Es conocido por actuar como agente quelante, es decir, forma complejos con los iones provenientes de metales pesados.
- Tiene capacidad de corrosión de metales ferrosos y aleaciones.
- Posee un efecto corrosivo en metales, formando de esta forma hidrogeno gaseoso inflamable.
- Se descompone por debajo de su punto de ebullición.
- También genera descomposición al entrar en contacto cianuro, fenoles, cetonas, alcoholes, sulfuros, ésteres entre otros.
- Al quemarse forma vapores tóxicos de óxido de fósforo.
- Su acidez es de pH: 1,5 (solución 0,1 N en agua) pKa: pKa1= 2,148; pKa2= 7,198 y pKa3= 12,319. Por consiguiente, su hidrógeno más ácido es el primero.
- Se polimeriza de forma violenta con compuestos azo, polimerizables y epóxido.
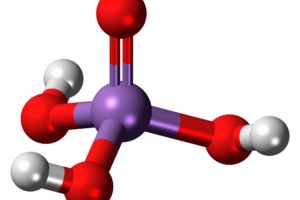
- Su fórmula molecular es H3PO4
- Cuenta con un peso molecular de 97,994 g/mol