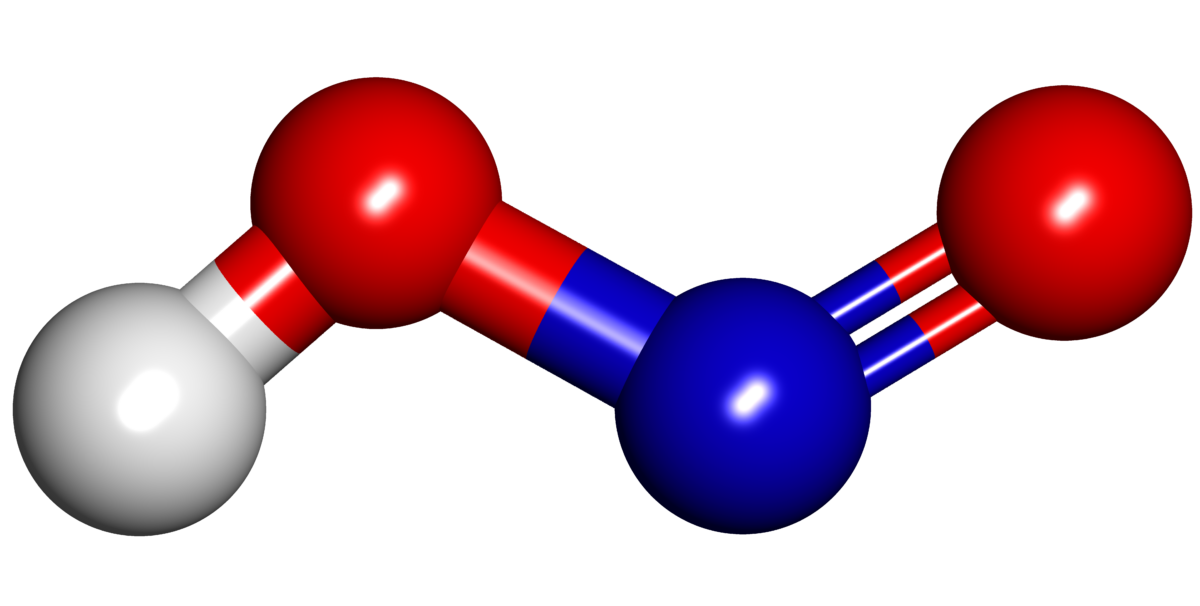
El ácido nitroso (HNO2), también conocido como ácido dioxonítrico III, es un ácido inorgánico clasificado dentro de los ácidos oxácidos. Se ubica como un ácido moderadamente fuerte a débil y se encuentra de forma estable en estado acuoso. En su estado sólido, se presenta en forma de sales como el nitrito de sodio (NaNO2) y el nitrito de potasio (KNO2). Estas sales son particularmente comunes y tienen diversas aplicaciones (1). El ácido nitroso es monoprotico, lo que significa que solo tiene un átomo de hidrógeno que puede ser fácilmente desplazado para formar otros compuestos como sales y aminas.
El ácido nitroso es importante en reacciones químicas como la transformación de aminas en diazos. Esto implica que la oxidación de las aminas produce una desaminación de la amina, mientras que la oxidación de citosinas libera nitrógeno de las aminas alifáticas primarias. En el caso de aminas secundarias en cadenas alifáticas, se forman nitrosoaminas (2).
Ácido Nitroso. Foto por Openverse.
Propiedades del ácido nitroso
- Peso molecular: 47.013 g/mol
- Densidad: 1 g/ml
- Acidez: 3.398 pKa
- Apariencia color: Color azul pálido
- Solubilidad: Soluble en agua
- Fórmula molecular: HNO2
La estructura del ácido nitroso es plana, y la distancia de enlace entre el oxígeno y el nitrógeno es de aproximadamente 117.7 pm, debido a la presencia del doble enlace. Esta formación del doble enlace causa que los átomos estén más cercanos, gracias a una mayor atracción electrónica entre ellos (3). La distancia entre el oxígeno y el nitrógeno con un enlace sencillo es de 143.3 pm, y este átomo de oxígeno está unido a un átomo de hidrógeno. Los ángulos de enlace varían debido a la mayor densidad electrónica de los átomos de oxígeno (4).
Usos del ácido nitroso

El ácido nitroso tiene una amplia gama de aplicaciones. Es utilizado tanto en la industria farmacéutica como en la industria alimentaria. Debido a su alta reactividad como oxidante, se usa en procesos que implican la liberación de yodo (5).
En la medicina, se emplea para tratar enfermedades cardíacas, utilizando ésteres de nitrito como el nitrito de amilo y de alquilo. También se usa para tratar la disfunción eréctil y prolongar la eyaculación, aunque su consumo para estos fines debe ser controlado debido a sus efectos euforizantes (6).
Además, el ácido nitroso contribuye al equilibrio del ozono en la troposfera. En esta capa de la atmósfera, actúa como un importante vasodilatador (-NO2) (7).
Por último, se utiliza en la fabricación de explosivos, siendo uno de los precursores más comunes en la industria militar, minera y comercial. Dentro de los compuestos nitro naturales se encuentra el cloranfenicol, un antibiótico usado para el tratamiento de infecciones bacterianas de amplio espectro (8).
Otros usos del ácido nitroso

El ácido nitroso y sus derivados tienen una amplia gama de aplicaciones en diversas industrias. En la industria de pinturas, las sales de diazonio se utilizan para preparar colores azoicos, que son colores brillantes empleados en pinturas a base de aceite y también en aquellas conocidas como “brillo de seda”(9).
El nitrito de sodio (NaNO2) es crucial en la síntesis de compuestos orgánico-nitrogenados y actúa como un precursor de productos farmacéuticos. Además, se utiliza en la fabricación de tintes para el cabello y en la producción de pesticidas y herbicidas para controlar plagas y malezas en los cultivos(10).
El nitrito de potasio (KNO2) es un aditivo vital en la industria cárnica para la fabricación de embutidos. Es insustituible para la prevención de la intoxicación por botulismo que podría ser causada por el consumo de productos cárnicos como salchichas y mortadelas(11).
En el ámbito artístico, el ácido nitroso se utiliza en aerografías para vehículos, ofreciendo un toque más personalizado. También se emplea en la tintura de varios tipos de tejidos(12).
Riesgos de utilizar el ácido nitroso
Es fundamental tener en cuenta los riesgos asociados con el uso del ácido nitroso. La Organización Mundial de la Salud lo ha clasificado como un compuesto carcinógeno, lo que significa que puede inducir cáncer al degradar aminoácidos y formar nitrosaminas(13).
Además, el ácido nitroso puede modificar la secuencia del ADN, especialmente en mujeres embarazadas. Estas modificaciones podrían dar lugar a enfermedades hereditarias, tales como:
- Anemia de Fanconi: Se caracteriza por una falla en la médula ósea y el desarrollo de leucemia mielocítica aguda.
- Síndrome de Cockayne: Se caracteriza por sensibilidad a la luz solar y una apariencia de envejecimiento prematuro.
- Xerodermina pigmentosa: Se manifiesta en el desarrollo de cáncer de piel(14).
El ácido nitroso y sus derivados también pueden ser altamente explosivos en ciertas condiciones. Por ejemplo, en presencia de bases como el hidróxido de sodio, pueden explotar(15). Aunque el ácido nitroso tiene aplicaciones útiles, es crucial manejarlo con extremo cuidado para minimizar sus riesgos a la salud y seguridad.
Como se obtiene el ácido nitroso
El ácido nitroso puede ser obtenido de varias maneras, incluida la reacción de sales ternarias con ácido sulfúrico (H2SO4) (16). La ecuación química que representa esta reacción es:
Ba(NO₂)₂(aq)+H₂SO₄(aq)→2HNO₂(aq)+BaSO₄(aq)
Otra forma común de obtener ácido nitroso es la reacción del óxido de nitrógeno (III) con agua. Es importante tener en cuenta que el ácido nitroso es inestable y, por lo general, sólo se obtiene en forma acuosa. La inestabilidad de este ácido provoca que se descomponga en gases como el dióxido de nitrógeno (NO2) y el monóxido de nitrógeno (NO), además de vapor de agua(17).
Aplicaciones y Riesgos
Este ácido también tiene aplicaciones en la industria farmacéutica, donde se usa en el tratamiento de enfermedades cardiacas y enfermedades infecciosas causadas por bacterias. Además, es esencial en la fabricación de explosivos de uso militar y minero(18).
Es crucial reconocer que el ácido nitroso es un compuesto que puede afectar negativamente tanto la salud humana como el medio ambiente. Por ser un compuesto inestable, puede liberar gases que, si se inhalan, pueden ser perjudiciales. Por lo tanto, es fundamental que su manejo se realice siguiendo estrictas normas de seguridad(19).
Referencias:
- Housecroft, C. E., & Sharpe, A. G. (2012). Inorganic Chemistry (4th ed.). Pearson.
- Jones, R. G. (2010). Nitrosation Reactions and the Chemistry of Nitric Oxide. Elsevier.
- Pauling, L. (1960). The Nature of the Chemical Bond (3rd ed.). Cornell University Press.
- Greenwood, N. N., & Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann.
- Cotton, F. A., & Wilkinson, G. (1988). Advanced Inorganic Chemistry (5th ed.). Wiley.
- Ignarro, L. J. (2002). Nitric Oxide: Biology and Pathobiology. Academic Press.
- Finlayson-Pitts, B. J., & Pitts, J. N. (2000). Chemistry of the Upper and Lower Atmosphere. Academic Press.
- Golan, D. E., Tashjian, A. H., Armstrong, E. J., & Armstrong, A. W. (2017). Principles of Pharmacology: The Pathophysiologic Basis of Drug Therapy (4th ed.). Wolters Kluwer.
- Zollinger, H. (2001). Color Chemistry: Syntheses, Properties, and Applications of Organic Dyes and Pigments. John Wiley & Sons.
- Feigl, F., & Anger, V. (1966). Spot tests in organic analysis. Elsevier.
- Honikel, K. O. (2008). The use and control of nitrate and nitrite for the processing of meat products. Meat Science, 78(1-2), 68-76.
- Swift, A. (1997). Coloration of textiles. Fibres & Textiles in Eastern Europe.
- World Health Organization. (2012). Chemical carcinogens. WHO.
- Ciccia, A., & Elledge, S. J. (2010). The DNA damage response: making it safe to play with knives. Molecular cell, 40(2), 179-204.
- Urbanski, T. (1967). Chemistry and technology of explosives (Vol. 3). Pergamon Press.
- Housecroft, C. E., & Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Pearson Education.
- Chang, R. (2010). Química (10th ed.). McGraw-Hill Interamericana.
- Tietz, N. W. (1995). Clinical Guide to Laboratory Tests (3rd ed.). W. B. Saunders Company.
- Occupational Safety and Health Administration (OSHA). (2007). Nitrous Oxide. OSHA Fact Sheet.
Más información sobre el Ácido Nitroso
- ÁCIDO NITROSO » Propiedades, Usos y Riesgos
- Contaminación Ambiental por Ácido Nitroso » Descomposición
- Consecuencias en la Salud por Ácido Nitroso » ¿Cuáles son?
- Riegos del Uso de Ácido Nitroso » Identificación y efectos
- Ácido Nitroso como Colorante » Aplicaciones y riesgos
- Ácido Nitroso en la Alimentación » Aplicación y precaución
- Usos del Ácido Nitroso » Descubre dónde encontrarlo
- Compuestos del Ácido Nitroso » Componentes y aplicaciones
- Cómo se Forma el Ácido Nitroso » Descubre sus reacciones
- Solubilidad y Descomposición del Ácido Nitroso » Razones y riesgos
- Propiedades del Ácido Nitroso » Conoce sus características
Además de toda la información sobre el ácido nitroso, quizá te interese:
Usos en la agricultura
El uso de diferentes ácidos en la agricultura, es muy amplio. Ya que tienen potenciales químicos diferentes, tenemos que el ácido nitroso se puede utilizar como fertilizante. Por otro lado, podemos ver que el ácido sulfúrico es el ácido que más usos tiene en la industria, uno esencial es en la agricultura, usado como pesticida y fertilizante de las plantas. Su uso debe ser cuidadoso ya que es altamente corrosivo. Más detalles en: https://www.todoellas.com/hogar/acido-sulfurico/
Los fertilizantes suelen ser productos que ayudan mucho para proteger de las plagas las siembras en la agricultura. En dicho productos es en donde encontramos el ácido nítrico. Además lo podemos usar para la elaboración de ciertos explosivos y para el mantenimiento de productos alimenticios.
Siguiendo con este mismo ámbito, encontramos las diferentes aplicaciones del ácido fosfórico, usualmente la de la alimentación, pero ocupa un papel interesante en los productos fertilizantes. Ya que también aprovecha el fosfato natural, que es el estiércol de los animales.
Así mismo, el uso del sulfato de cobre en piscinas es muy común, pero al usarlo con frecuencia se debe utilizar material adecuado, guantes y gafas protectoras. Su constante uso puede ser corrosivo para la piel y para los ojos, que son los más dañados por su delicadeza
Cuerpo y organismo sano
Estar sanos no es algo solamente estético, sabemos que el organismo sano es lo que más cuenta. El inhalar o tocar el ácido nitroso no suele dar beneficios al cuerpo, pero consumir el ácido cítrico, puede ser una forma muy buena de empezar a ser sanos desde el interior. Alimentarnos con naranja, kiwi, piña y demás, nos dará una mejor piel y fortalecerá en gran medida nuestro sistema inmune.
La inhalación o el contacto directo con el ácido perclórico, puede causar varios daños al organismo. Es una sustancia reactiva y oxidante, por lo cual se usa mucho en la industria de metales. Puedes ver sus riegos y fórmula en: https://www.todoellas.com/hogar/acido-perclorico/
Por otra parte, sabemos para qué sirve el ácido retinoico, que es en su mayoría, para cremas y productos que mejoren el aspecto de la piel facial. Y aunque es muy beneficioso, su mal uso puede causar daños importantes como irritación en la piel, picor y hasta descamación de la misma.
Quizá te interese:
- Uno de los usos del ácido sulfhídrico se da en las pinturas, ayuda al ennegrecimiento de ellas, en las que son hechas a base de carbonato de plomo
- Para seguir potenciando la salud física, las propiedades del ácido hialurónico lo podemos ver en diferentes productos cosméticos; esto es porque sus beneficios en la piel ayudan a retrasar el envejecimiento, y además, a eliminar cicatrices de quemaduras.
- Entre las propiedades del ácido fórmico encontramos la de descomponer plásticos y algunos metales. Sus efectos pueden ser peligrosos si se exponen los ojos por mucho tiempo a sus efectos.
- Para mantener limpio el colon y el intestino en buenas condiciones, se recomienda consumir vitamina C, la cual ayuda a potenciar una buena digestión y mejorar el desempeño físico. En la comida y cosmética podemos encontrar los usos del ácido ascórbico.
- Los usos del ácido oleico son muchos, además de sus beneficios en el organismo y de encontrarlo en diferentes alimentos, se utiliza para la industria cosmética. Los aceites naturales de este agente químico, ayudan a mejorar el aspecto de la piel.